химическо действие
§ 27. химическа действието на електрическия ток
Разтворите на солите и киселини във вода или друг разтворител поведение електрически ток и се наричат електролити или проводници от втория вид, за разлика от метални проводници, проводниците на първия вид, посочени.
Електрическият ток може да премине през среда с електрически заредени частици, които имат способността да се движат.
Когато разтворени соли и киселина във вода или друг разтворител (етилов алкохол, бензин, бензен, и т.н.) на молекулите се разделя на две части, наречени йони. една част е положителна, а другата - отрицателен заряд.
По този начин, за разлика от метални проводници, където електрически носители са електрони, те са йони в електролити.
Йоните могат да бъдат прости или сложни. Обикновено йон вещество се образува от един атом. Йоните, състояща се от няколко атома, се наричат сложни.
Разпадане на химични съединения в йони под влиянието на разтворителя се нарича електролитна дисоциация и се изразява чрез конвенционални химични уравнения от лявата страна са поставени химичните символи дезинтегриращи агенти и отдясно - йони, образувани от тези вещества. Например, дисоциация уравнението на сол (натриев хлорид) може да се запише, както следва:
Ако в съд с електролит да се потопи на две метални плочи, известен електроди, които от тел води свързан към клемите на захранващия източник DC, поради потенциалната разлика между електродите през електролита на ток. Преминаването на ток през електролита придружава от химични процеси, като общата заглавието електролиза. Разположен в електролитни йони са привлечени към електродите, движещи се в противоположни посоки, на положителните йони - на катод, а отрицателна - към анода. Подход на катода, положителни йони, произведени от нея липсващите електрони и образуват електрически неутрални атоми. В анода обратния процес се извършва: анодните отрицателни йони дават техните свободни електрони. Например в електролиза на разтвор на натриев хлорид се отлагат върху катода положителни натриеви йони, и анода - отрицателните хлорни йони (. Фигура 24).
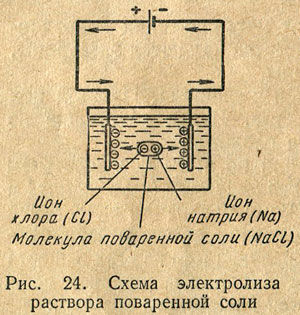
В резултат на непрекъснат преход на електрони от катода в йони и влизането им към анода се поддържа от движението на електроните в проводниците, свързващи електрически източник на захранване на електродите.
С преминаването на електрически ток през електролита към електродите са разпределени определено количество от вещества, съдържащи се в химично съединение в електролита. Зависимостта на избрания материал за текущото съдържание е разположен право първи Фарадей, който е формулиран, както следва: количество вещество освободен в електродите чрез преминаване ток през електролита е пряко пропорционална на количеството на ток преминава през електролита. С течение на електроенергия от висулка на електролита разпределя определено количество тегло на вещество, което се нарича електрохимичен еквивалент на веществото.
В практически изчисления за определяне на размера на електроенергия е по-удобно да не се използва висулки (к), а амперчаса (Ah).
Електрохимично еквивалент се изразява в грамове, свързани с един О електрически количество (T / A · з), т. Е. Определя размера на теглото на материал освободен от електролита и изразено в грама, докато преминава през електролита 1 и · з електрически количество.
Обозначаващ I продължава сила на тока, протичащ през електролита по време на т з а електрохимичната еквивалент от веществото -. Чрез к. определи сумата от теглото на веществото в гр гр освободен през това време:
Пример. Ако токът преминава през електролита в mednokisly 1 и в продължение на 1 час при катода се отделя 1186 г мед, след това с ток от 10 А от същия разтвор в продължение на 10 часа подчертано 1186 х 10 х 10 = 118,6 грама.
Най-широко използвани за електролиза на прилагане на относително тънки покрития на определени метали от друга (галванично). Галванопластика се използва за придаване на декоративни предмети за външен вид и защита от корозия. По този начин производство на златно покритие, сребро, никелиране, и така нататък. D.
Електролизата се използва също така за пречистване (рафиниране) на метали като мед. Суровият медна плоча, получен чрез калциниране на рудата се потапя като анод в баня, съдържаща разтвор на меден сулфат се подкислява със сярна киселина за подобряване на проводимостта на електролита. Катоди в тези бани са тънки медна плоча, върху която се нанася електролитна мед, и примесите депозирани на дъното на ваната.
Много общ метод за производство на електролитен каустик основи натрий, калий и хлор и кислород и водород.