атом модел
изпитате Ръдърфорд
Насладете Ръдърфорд. Лъч положително заредени алфа-частици, изпускани от радиоактивни елементи, насочени към свръхтънки златно фолио от около 400 пт дебел. Частиците преминават през фолиото, записани на екрана с помощта на микроскоп.
Многобройни опити са показали, че много рядко, но-частици се отклоняват значително ъгъл (90 0 и 180 0). Както той пише на Ърнест Ръдърфорд (1871-1937). "Това беше почти толкова малко вероятно, като че ли прострелян в лист хартия тъкан 15-инчов корпус, и той е да се върна обратно и влезе в теб."
Какво би могло да означава това? Фактът, че има много силен електрическо поле вътре в атома, който е създаден положителен заряд, концентриран в много малък обем. Името "ядрото" беше предложено от Ръдърфорд. Ядрото също концентрира цялата маса на атома.
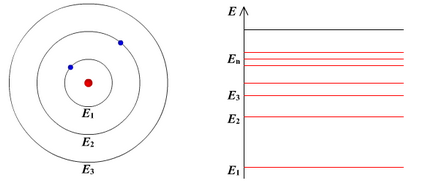
Ядрената модел на атома
През 1911, Ernest Rutherford, предложен ядрената модел на атома.
Според този модел, в центъра на атом е положително заредена ядро, която се фокусира почти цялата маса на атома (99,96%). Диаметърът на сърцевината не превишава 10 -14 -. 10 -15 m Atom общо неутрален. Около ядрото на затворени орбити се върти под действието на силите на привличане Кулон на електроните от ядрото. В състояние на покой не електрони mogut.Zaryad ядро трябва да бъде равна на общата заряд на електроните, принадлежащи на атома. Това означава, р = + Ze = -Ze. където Z - на поредния номер на елемента в периодичната таблица. д - начално зареждане.
квантовата постулати на Бор
Ядрената атомен модел не може да обясни следното противоречие: в орбита, той трябва да излъчва електромагнитни вълни, когато електронът се измества. Следователно загубите на енергия и 10 -13 да престане да съществува. Спектърът на излъчване атом трябва да бъде непрекъснато, а не ред спектър.
Нилс Бор Хендрик Дейвид (1885 - 1962) през 1913 г., предложен квантов модел на атома на базата на следните постулати лъже.
Аз постулира Бор (постулат стационарни състояния). електрон на атом може да присъства само в специални (квантови) състояния, всеки от които съответства на определена енергия. Когато електронът е в стабилно състояние, въртяща се в своята орбита, тя не излъчва.
Стационарни състояние може да се брои, и всяка държава има своя определена енергия.
II Бор постулираме (обикновено честоти). атом при прехода от едно стационарно състояние в друго, излъчвана или абсорбира фотон на електромагнитно лъчение, чиято енергия е равна на разликата между енергия на електрона състояния на данните.
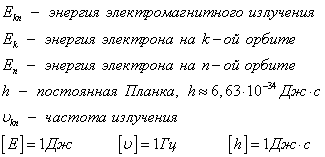
Ако ЕО> BG на. енергийно излъчване, което се случва, ако ЕК <Еn - ее поглощение.
Членка на атома, което съответства на най-ниска енергия се нарича земята. държава с повече енергия - развълнуван. В основното състояние, електрона може да остане за неопределено време, но в други държави не повече от 10 -8 ите.
II Бор постулираме възможно да се обясни линия структурата на атомните спектри.
III Бор постулираме (квантуване правило орбити). стационарни електронни орбити са открити от условието
