В клетка - studopediya
Галванична клетка - източник на ток химически, където енергията, освободена по време на протичане на електродите на реакцията на редокс се превръща директно в електрическа енергия.
Принципът на работа на клетката може да се разглежда от примера на Daniel елемент - Jacobi (фигура 9.2).
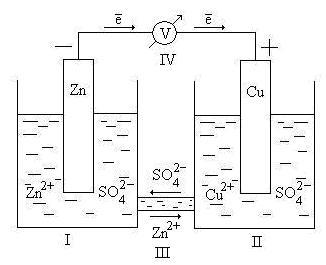
Фиг. 9.2. Схема Даниел галваничен елемент - Якоби
Тук - чаша, съдържаща разтвор ZnSO4 във вода с потопен в него цинков плоча; II - чаша, съдържаща разтвор на CuSO4 във вода с това потопени в медната плоча; III - сол мост (електролитна ключ), която осигурява движение на катиони и аниони между разтворите; IV - волтметър (необходима за измерване на електродвижещата сила, но част от клетката не е включена).
стандартен потенциал електрод на цинков електрод. стандартен потенциал електрод от мед електрода. Тъй като. цинк атоми са окислени:
Електродът, в който окислителната реакция, който изпраща или катиони в електролит, се нарича анода. С оглед на електрохимичната клетка служи като анод цинков електрод. От стандартната електрод потенциал на цинк е по-ниска от тази на мед, цинк електрод се дължи на кондиционираната заряд "-", и мед - "+".
Електроните освободени чрез окисление на медни постъпления (електрически ток) на външната верига.
На мед електрод е процесът на възстановяване на електролит Си2 + катиони:
Електродът при което редукция е kotoryyprinimaet или катиони от nazyvaetsyakatodom на електролита.
След ключа електролитна е движение на йони в разтвор: SO4 2- аниони на анода, Zn2 + катиони към катода. Движението на йони в разтвор завършва електрическата верига на електрохимичната клетка.
Реакции (а) и (б) са наречени реакции на електрода.
Комбинирането уравнения процеси, протичащи на електродите, общото уравнение получи редокс реакция, протичаща в клетката:
Zn + Cu 2+ = Zn 2+ + Cu