при представяне на амоняк 1
Презентация на тема ". Амоняк 1. Състав Структура 3. Физически свойства 2. Изготвяне на амоняк в лаборатория в промишлеността 4. Химични свойства 5. 6. Тест за кандидатстване." - Препис:
1 1. Състав на амоняк. Структура 3. Физични свойства 2. Получаване на амоняк в лаборатория в промишлеността 4. Химични свойства 5. 6. Прилагане на изпитване

2 1. химичната връзка в молекулата на амоняк: а) йон; B) полярен ковалентна; B) неполярен ковалентна. 2. Как може амоняк, получен в лабораторията: а) чрез директна синтеза от азот и водород; B) разлагане на амониева сол; B) взаимодействие амониеви соли с основи. 3. Както може да се различат амониев хлорид и натриев хлорид: а) миризма; В) чрез действието на сребърен нитрат; В) чрез действието на алкален при нагряване. 4. Водният разтвор на амоняк взаимодейства: а) със солна киселина; B) калциев хидроксид; В) с вода. 5. амоняк може да се окисли до свободен азот: А) без катализатор; B) при повишено налягане; В) с катализатор. 6. Механизмът на образуване на йон (катион) амониев: А) донор-акцептор; B) йон; B) радикал; 7. реакция на Уравнение NaOH + NH4 Cl = NaCl + NH3 + Н 2О Съответстваща йонен кратко: А) NH Н + = NH 4 + б) NH 4 + NH3 = + Н + В) NH OH = NH 3 + Н 2О B B B A A B

3 Състав. Структурата на NH 3 N 1s21s2 2s22s2 2p32p3 + Н N H H3H Н N 1s11s1 + δ + δ + δ + δ + δ + δ-δ-δ Н или Н Н HN 107,3º полярен ковалентна Кристални химична връзка молекулна решетка
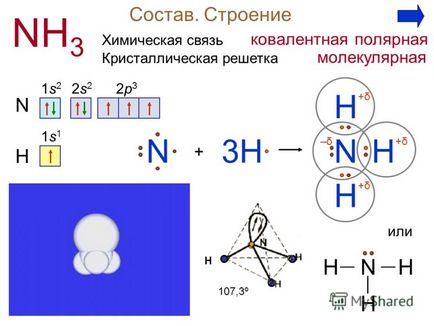
Получаване 4 В Амоняк лабораторната слаб получава чрез нагряване на смес от калциев хидроксид и амониев сулфат. Направи реакция уравнение за получаване на амоняк. Са (ОН) 2 + 2 (NH 4) 2SO 4 = CaSO 4 + 2NH 3 + 2Н 2О В промишлен амоняк дава синтеза на азотен смес от 200 атм, 400 ° С, Fe N 2 + 3H 2 2NH 3 или Са (ОН) 2 + 2NH 4 Cl = CaCl 2 + 2NH 3 + 2Н 2О опит
6 Физични свойства амоняк - безцветен газ с остър характерен мирис, по-лек от въздуха. Определя се плътността на амоняк във въздуха. С леко увеличение налягане или при охлаждане до - 33Sº амоняк втечнява, преминавайки безцветно мобилен течност. Амонякът е разтворим във вода при стайна температура 1obeme 700 обема вода разтворим амоняк, при 0 ° С - 1200 обеми. D Sports. (NH3) = М (въздух) / = М (NH3) 29 г / мол / 17 г / мол = 1,7raz

7 химичните свойства на NH 3 + Н 2О NH 3-H 2 O NH OH - 1) разтваряне на амоняк във вода се придружава от химическа реакция с него: N Н + H + + Н HH HH HHN + донор акцептор амониев катион 2) взаимодействие на амоняк с киселина : NH3 + = HCl на NH4CI Направи уравнение амоняк реакции със сярна киселина (за образуване на вторични и кисели соли), азотна киселина. NH 3 + H 2 SO 4 = (NH 4) 2SO 4, NH 3 + H 2 SO 4 = NH 4 HSO 4 механизма на образуване на връзка - донор-акцептор NH 3 + HNO 3 = NH 4 NO 3 опит
8 Реакцията на амоняк с хлороводород
9 взаимодействие на амоняк с киселина
03 октомври) Окислението на амоняк (катализатор) 4NH 3 + 5О 2 = 4NO + 6Н 2О Реакциите като редокси. Какви са антиоксиданти, редуциращи агенти. N -3 - 5e N окисляване О д 2О -2 4 май разтваряне NH3 (дължи на N-3) - редуциращ агент; За 2 - окислител.

04 ноември) окисляване на амоняк (без катализатор) 4NH 3 + 3O 2 = 2N 2 + 6Н 2О Реакциите като редокси. Какви са антиоксиданти, редуциращи агенти. N -3 - 5e N окисляване О д 2О -2 4 май разтваряне NH3 (дължи на N-3) - редуциращ агент; За 2 - окислител. 5) Амоняк е способно да редуцира металните оксиди неактивни NH 3 + N 2 CuO + Cu + Н 2О Реакциите като редокси. Какви са антиоксиданти, редуциращи агенти. Подредете коефициентите. 2N -3 - 6Е N окисление на Cu д Cu възстановяване NH3 (дължи на N-3) - редуциращ агент; CuO (за сметка на Cu 2) - окислител. 2NH 3 + 3SuO = N 2 + 3Cu + 3H 2О опит
12 амоняк горене в кислородна

13 юни) активни метали може да замести водороден атом в амоняк. Парче от натрий, в течен амоняк се намалява, то оцветява лилав цвят, цвят изчезва с времето, и след изпаряване на амоняка в долната част на стъклото остава бял прах натриев амид: Да разгледаме отговор като редокси. Какви са антиоксиданти, редуциращи агенти. Подредете коефициентите. NH 3 + Na NaNH 2 + Н 2 2Н д Н Na 0 - 1е Na NH3 (поради Н 1) - процеса на възстановяване окислител; Na 0 - процес редуктор окисление. 2NH 3 + 2Na = 2NaNH 2 + Н 2 натриев амид
14 Laboratory опит: Информацията Повторение амониеви соли качествена реакция на амониев йон. Поставете флакона в смес от амониев хлорид и калциев хидроксид и сместа се загрява. Определя получената характерен мирис на амоняк и се използва влажна индикаторна хартия.
1. Използването на амоняк 15 Производство на пластмаси и влакна 2. В детергенти 4. В селското стопанство, медицината 4. 6. Получаване на експлозивите 5. Производство на азотна киселина 3. Производство на азотни торове
17 1. воден разтвор на амоняк е: а) алкална среда; B) кисела среда; B) неутрална среда; D) има правилен отговор сред по-горе. 2. Реакцията на амоняк с хлороводород се отнася до реакции. А) разлагане; В) съединения; B) заместване; D) обмен. 3. амоняк реагира с нагрятата меден оксид (II), това възстановяване на метална мед. Когато това амоняк се окислява до: а) без азот; B) азотен оксид (IV); B) азотен оксид (II); D) на азотен оксид (V). 4. Не е реакция редокси на амоняк с: а) кислород в отсъствието на катализатор; B) кислород в присъствието на катализатор; C) солна киселина; D) оксид меден (II). 5. лабораторен метод за производство на амоняк е: а) синтез от азот и водород; B) взаимодействие на амониев хлорид с алкален; B) разлагане на амониев хлорид; D) всички горепосочени отговори са верни. 6. Добави уравнението на реакцията на амоняк с сярната киселина в моларни съотношения 1: 1 и 2: 1. Сумите коефициентите в тези реакции са А) 3 и 5; B) 3 и 4; B) 4 и 5; D) 5 и 6. G A B B B