Ядрената модел на атома - преглед, страница 1
Ядрената модел на атома
Ръдърфорд въз основа на експеримент разсейване
а-частици върху заземен метален фолио атома планетарен модел на атомната структура.
Според този модел, атомът се състои от тежка положително заредена ядро на много малки размери (
10-15 т), около която електрони се движат по някои орбити. Радиусите на тези орбити имат размери
Наличието на заряда на електрона прави планетарния модел на противоречивите условията на класическата физика, тъй като въртене на електрона около ядрото, като всеки бързо движещи се зарежда частиците трябва да излъчва електромагнитни вълни. Спектърът на такава радиация трябва да бъде непрекъснат. В експерименти наблюдава атома линеен спектър радиация. В допълнение, непрекъснатото излъчване намалява енергия на електрона, и това се дължи на намаляването на орбита би трябвало да падне в ядрото.
Нилс Бор постулати
Niels Бор "спасен" планетарен модел водороден атом, формулиране три постулати.
1. електрон на атом може да се движи само в някои стационарни орбити с определен брой п = 1; 2; 3; ... Преминавайки фиксирана затворена орбита на електрона има постоянна общата енергия En.
2. право стационарни орбити са само тези, за които моментът на импулса на електроните е равен на интегрален множител стойност на константата на Планк
3. емисия на фотони или абсорбция се извършва при прехода от един атом стабилно състояние в друго. Честотата на радиация
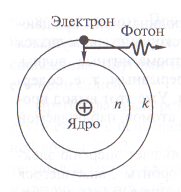
Изчисляване на водородния атом на Бор
тези - масата на електрона
Решаването на системата от тези две уравнения, получаваме:
където а = 0.529. 10-10 м - радиус на първия неподвижен
орбити на водороден атом
Кинетичната енергия на електрона
Потенциалната енергия на електрона
Общата енергия в р-та орбита
Честотата на радиация при прехода от състояние за получаване на N
, където - константа на Ридберг
Има и константата на Ридберг за ν и λ:
За атоми водород (хелий йон Той + Z = 2, dvuhkratno- йонизирана литиева Li ++ в Z = 3, +++ trohkratnoionizovanny берилий Be с Z = 4 и т.н.) са радиусите на електронните орбити по време на Z-малък от водороден атом и енергиен спектър водороден йон се получава чрез умножаване с Z2
квантовата теория на атома
Въпреки че теорията на Бор дава добри резултати за водородни атоми, то не може да се счита за завършена теория на атомните явления.
От гледна точка на съвременната физика атом е физическа система, която със сигурност не може да се опише чрез класическата теория, не се вземат под внимание вълнови свойства на електроните, които се движат в атома като де Broglie дължина на вълната на електрона е сравнима с атомни размери.
Потенциалната енергия на взаимодействие на електрона с ядрото на водород като атом
Г- разстояние между електрона и ядрото, което на първо приближение
Ние ще се разглежда като точка.
Предложение на електрон в такова поле може да се разглежда като движение в сферична потенциал добре.
Спектърът на електрон енергия трябва да бъде отделен, т.е. Тя се състои от отделни енергийни нива, с
стойностите на общия енергиен Е 1 на електрона; Е 2; E 3 и т.н.
Шрьодингер уравнение е
Разтворът на това уравнение се извършва в сферични координати R, θ, φ. чийто център съвпада с центъра на ядрото на атома. В такава система,
С помощта на квадратен оператор ъглов момент в сферична координатна система
Шрьодингер уравнение се превръща в
Решението на това уравнение търсите в един продукт на две функции с множество променливи
C, като се вземат предвид естествените изисквания, наложени на Ψ- функция трябва да е недвусмислена, крайно, непрекъсната и гладка.
В процеса на решаване се установи, че тези изисквания могат да бъдат изпълнени за всички положителни стойности на енергията Е, но отрицателните стойности на E - само при дискретни стойности, а именно, ако
което съответства на свързаните състояния на електроните в един атом.
Така резултати Шрьодингер уравнение разтвор в случай на Е 1 2 3 4 Виж всички