Химическа действие на електрическия ток - studopediya
Разтворите на солите и киселини във вода или друг разтворител поведение електрически ток и се наричат електролити или проводници от втория вид, за разлика от метални проводници, проводниците на първия вид, посочени.
Електрическият ток може да премине през среда с електрически
заредени частици, имащи способността да се движат.
Когато разтворени соли и киселина във вода или друг разтворител (. Етилов алкохол, бензин, бензен, и т.н.) на молекулите се разделят на две части, наречени йони, при което една част има положителен заряд и другата - отрицателен заряд.
Ако в съд с две метални плочи електролитни доставят наречени електроди, които от тел води свързан към
DC източник на енергия, поради потенциалната разлика между електродите през електролита на ток.
Преминаване на ток през електролита придружен от химичен процес, наречен електролиза. Разположен в електролитни йони са привлечени към електродите, движещи се в противоположни посоки, положителните йони - катода, докато отрицателни йони - анода.
Подход на катода, положителни йони, произведени от нея липсващите електрони и образуват електрически неутрални атоми. В анода обратния процес се извършва: анодните отрицателни йони дават техните свободни електрони.
С преминаването на електрически ток през електролита към електродите се разпределя определено количество от вещества, съдържащи се в химично съединение в електролита.
Зависимостта на избрания материал по разплащателна комплект
Фарадей два закона.
Първият закон на Фарадей формулирани както следва: количеството на материята еволюира в електродите, когато токът преминава през електролита е пряко пропорционална на количеството на ток преминава през електролита.
С течение на електроенергия висулка от електролита се разпределя определено количество от масата на вещество, което се нарича електрохимичен еквивалент на веществото.
В практически изчисления за определяне на количеството на електрическата енергия, не е удобно да се използва висулки и амперчаса (Ah).
Тъй като една висулка равни ампер секунди, между ампер-часа и след висулка връзка притежава: 1 А = 3600 А = 3600-с Cl.
Електрохимично еквивалент К се изразява в грамове, прехвърлена на същото количество ампер-часа електроенергия (г / A * з) Т. Е. маса количество материал освободен от електролита и изразено в грама, докато преминава през електролита е един ампер-часа количество електроенергия ,
право Вторият Фарадей посочва, че: когато същото количество ток, преминаващ през различни електролити, маса брой вещества се утаяват на електродите, са пропорционални на техните химични еквиваленти.
От сравнението на 1-ви и 2-ри Фарадей право това означава, че електрохимични еквиваленти са пропорционални на техните химични еквиваленти, т. Е.
К1 / К2 = a1 / a2 = K3 / а3 =.
Следователно, съотношението на електрохимически еквиваленти на техните химични еквиваленти е постоянна и равна на
R / а = 3,72 / 0,0372 = 100;
По този начин, втория закон на Фарадей може да се изрази по следния начин.
К и х = 0,0372;
Електролизата е широко използван в различни индустрии: В галванопластика, галванични, за почистване (рафиниране) и други метали.
галванични клетки
Проводниците на първия вид (твърдо вещество) и от втория вид (течни електролити) се използват заедно в галванични елементи, служещи постояннотокови източници.
В галванични клетки по време на тяхната работа има движение на йони и отлагане на електродите на елемента, изпускани от електролит материал.
Най-простият елемент е галванични мед-цинков.
В стъклен съд, пълен с разтвор на сярна киселина във вода, потапя медни и цинкови плочи, които са положителни и отрицателни полюси на елемента.
Когато веригата затварящ елемент във всеки проводник в този елемент ще премине ток от отрицателната плоча цинк към положителния мед и външната верига на мед за цинк.
Под влияние на ток в клетката положителен водородни йони се движат по посока на течението, отрицателен остатък йони киселина - в обратна посока.
Връзка с медна плоча, положителни йони на водород дават такси им и водород газови мехурчета се натрупва в нейната повърхност.
В същото време, отрицателни йони на остатък сярна киселина дадат такси цинк плоча. По този начин има член на непрекъснато зареждане плоча, която поддържа потенциална разлика (напрежение) на клемите му.
Изолиране на водород елемент медна плоча отслабва действието му - поляризиращ елемент.
Феноменът на поляризация е, че се натрупват на положителния електрод генерира водород в комбинация с допълнителен метален електрод потенциална разлика се нарича електродвижеща сила поляризация. Това електродвижеща сила е насочена срещуположно на електродвижещата сила клетката.
Освен това, водородни мехурчета, които обхващат част от медната плоча, намалява действа му повърхност, и това повишава вътрешното съпротивление на клетката.
Поляризация при разглеждането на елементите е толкова голяма, което го прави неподходящ за практически цели.
С цел отстраняване на явлението поляризация на абсорбер се въвежда в елемент (depolarizer), която е предназначена да абсорбира водород и натрупване nedopuskaet елемент към положителния полюс.
Depolarizers могат да бъдат химикали, кислород-съдържаща или хлор.
На електродвижещата сила на мед-цинков елемент е 1.1V и вътрешното съпротивление като функция на времето на работа - 5,10 ома.
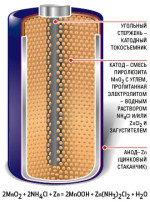
въглерод-цинкови клетки положителния полюс плоча е въглища,
и отрицателен - цинк прът.
Depolarizer в този елемент е натиснат по смес с високо налягане, наречено агломерат. Той се състои от пероксид манган и графит.
Електролитът в цинков въглерод клетка се използва воден разтвор на амониев хлорид.
На електродвижещата сила на цинк-въглерод клетка 1,4-1,5 В началото на освобождаване при средна стойност от 0.9-1.1 V, и вътрешното съпротивление като функция на структурния елемент - 0,25-0,7 ома в началото на освобождаване, и 1.4-5 ома в края.
Цинк-карбонови елементи произвежда местната промишленост като така наречената суха клетка на видове чаши и galetnogo много удобни за носене и транспорт.
В сухо елементи на чаша тип положителния полюс е поставен вътре в агломерат с цинк кутия. който служи като отрицателен член полюс.
Пространството между стените на кутията и цинк агломерат напълнената с паста, състояща се от амониев хлорид и картофено брашно разтвор.
Над агломерат подредени картон подплата. който nasyplyut слой от стърготини; горния прах покритие уплътнение.
След това се излива елемент смола, в която е поставена тръба. Цел на тръба - за отстраняване на газове, образувани във вътрешността на елемента.
На излизане смола въглероден електрод nasazhivajut мед капачка
Винтове и гайки за свързване на проводник.
Към горната част на кутията на цинк (отрицателен полюс) е заварена изолиран гъвкав проводник. На дъното на кутията се поставя изолационен подплата.
Клетката вафла е отрицателен електрод плоча цинк, положителните - уплътнен прах бисквити манганов диоксид с въглерод.
Външната повърхност на цинк плоча е покрита с графитен слой колофонови частици за проводимост.
винил хлорид се използва като изолация филм.
Вафлена елементи са компактни и техните активни материали (особено цинк) се използва по-добре, отколкото в елемент чаша.
устройство на батерията се нарича, има способността да се натрупват и да се задържи за известно време, електрическа енергия чрез химични процеси.
Батерията, като в галванопластика клетка, електрически ток е в резултат на химически процеси.
Но за разлика от батерията в клетъчните резултат химични съединения не може да се разложи отново и приведени в първоначалното състояние на външен източник на ток.
Следователно, галванични клетки се наричат първични и акумулаторни батерии - вторичен или обратимо.
Повторното зареждане и разреждане е не само вредно за батерията, но дори и да подобри неговите свойства, тъй като цялата работа участва дълбоките слоеве на електродните плочи.
В зависимост от състава на батериите на електролита може да бъде кисела и алкална.
Най-простият кисели батерии
Състои се от две водещи плочи (електрод), потопени в електролита, който е вода с леко добавяне на сярна киселина.
Постоянен ток външен източник, преминаващ през електролита се разлага на съставните си части.
Вътре настъпва движение на електролита H2 положителен водородни йони плоча свързани към отрицателния полюс на източник на ток и отрицателни кислородни йони O до плоча свързан към положителния полюс на източника на захранване.
В резултат на електролиза се окислява на положителния електрод олово и гъба резултата се формира върху отрицателния електрод.
Ако батерията е изключен от източник на ток и в близост до някои енергия приемник, самия източник на енергия на батерията би искал електрохимична клетка, в която електродите са плочи, които се различават един от друг по химически състав.
Киселинен електролит батерии, както е посочено по-горе, служи разтвор киселина специфично тегло.
- Плътността на разтвор е число, което показва колко пъти масата на това решение е по-голяма от масата на вода на същия обем.
- Когато се приготвя разтвор за батерия, сярна киселина се излива в тънка струя във вода.
- Не е възможно да се излива вода в сярна киселина, тъй като бързото пръски случи киселина, която може да предизвика изгаряния.
- Вода за електролита трябва да се дестилира.
- едн батерия зависи от плътността на електролита и не зависи от размера и номинален капацитет.
- В процеса на зареждане на батерията и плътност разряд zlektrolita не остава постоянна, в резултат на тези промени като му електродвижещо напрежение и напрежението в egozazhimah.
промени График напрежение
киселина батерия:
1 - срещу заплащане,
2 - по време на разтоварване.
Количеството на електроенергия, че батерията може да се получи при някои разряден ток до най-ниската позволена напрежение, наречен капацитета си.
Тя е равна на произведението на тока в ампери заустване на времетраенето на разреждане в часове, и се изразява в амперчаса.
Свързване диаграма киселинни батерии плочи.
Капацитетът на батерията зависи от количеството на активния състав, количеството на ток и температура.
Съгласно номиналния капацитет да се разбере количеството електроенергия, която дава напълно зареден акумулатор на
10-часов режим на освобождаване и температура от 25 ° С
Така, батерията изпраща номинален капацитет, освобождаване за 10 часа шок е числено равно на стойност 0.1 с номинален капацитет.
Чрез увеличаване на разряден ток, капацитета на батерията намалява, тъй като повърхността на плаки, покрити с оловен сулфат електролит и труден достъп до вътрешните слоеве на активната маса.
Тъй като температурата се понижава вискозитета на увеличенията на електролит, което го прави трудно за достъп до вътрешните слоеве на активната маса и намалява капацитета на батерията.
За да се увеличи капацитета на акумулаторните плочи на като няколко свързани паралелно.
Всяка група от положителни и отрицателни плочи функционира като една голяма плоча, площта на която е равна на сумата от площите на свързани паралелни плочи.
Тъй като положителните плочи трябва да бъде между отрицателен, броят на отрицателните плочи винаги един по-голям от броя на положителна.
При това условие, двете страни на положителните плочи влизат в контакт с електролита (когато положителните плочи едностранно основа и късо съединение може да възникне при контакт с отрицателни плочи).
батерии стационарни киселина произведени в стъклени или керамични съдове. Батериите на големи контейнери имат дървени съдове или материал олово облицована киселина изолационна.
кисели батерии се използват в електрическата инсталация на стационарен тип и с кола.
Както преносими батерии се използват предимно алкални батерии.
Алкални батерии.
Съдовете запечатани алкални батерии от тънка ламарина и никел от външната страна. В центъра на капака на контейнера има отвор за изливане електролитни батерии.
Eds алкална батерия зависи от състоянието на активната маса на плочите. EMF на плътност температура и електролит зависи леко и само при ниски температури, близки до нула, се променя рязко.
Напрежението в края на батерията е 1.8 V, зареждането е завършен - 1.5-1.55 V;
едн изтощен акумулатор - 1.3 V.
Предимството на алкални батерии е, че
- те не се нуждаят от медицински грижи;
- не се страхува да се разклаща;
- може да бъде дълго в езотеричен състояние;
- вземат късо съединение, което за киселинни батерии са много опасни;
- самостоятелно отговорност в алкална батерия е по-малка от тази на киселината.
В зависимост от материала на батерии електроди алкални може да бъде никел-кадмий, желязо-никел, сребро, цинк, злато, цинк и газ.
Използването на голям мащаб злато-цинкови батерии се ограничава от тяхната висока цена.
Газови батерии са лесни и евтини, но технологията не е достатъчно развит тяхното производство.
Най-широко използваният никел-кадмий (KH)
и никел и желязо (LS) батерии, който служи като електролитен разтвор на калиев хидроксид във вода; електролит плътност 1.2.
Според неговото устройство данни и електрическа батерия и KH LS малко се различават една от друга.
Активната маса се пресова в брикети (пакети), и след това брикети са събрани от индивидуалните плочи.
В Тип батерия LS отрицателните плочи на една повече от положителни.
В KH батерия положителни плочи на един над отрицателен.
Един от полюсите на батерията е свързан към съда (в woh - отрицателен,
докато НС - положителния полюс).
Сребърен оксид батерия е пластмасов контейнер в който са поставени положителни и отрицателни електроди са съставени от отделни плочи.
Отрицателни електроди, направени от листа на цинков оксид, затворени в защитна опаковка от материал, който предава и електролита, но запазва метални частици.
Положителните плочи са от сребро.
За получаването на електрохимични клетки на батерията или батериите, няколко елемента, свързани последователно, т.е.. E.
катода на първия батерията е свързан към анода на втория,
втората катод - към анода на третия и така нататък ..
При което се получават свободни електроди, а именно анод и катод на първия елемент последния са съответно положителните и отрицателните полюси на батерията.
При определяне на електродвижещата сила на батерията на батерии п-киселина или електрохимични клетки с един елемент едн Eo и вътрешното съпротивление Ro = E едн nE0 батерия и вътрешно съпротивление R = nR0.