Галванична клетка схема, принципа на работа, използването на
За да се начертае на клетката, е необходимо да се разбере принципа на действията си, структурни елементи.
Потребителите рядко обръщат внимание на батерията и батерията, докато тези източници на енергия са най-популярни.

химични източници
Какво е галваничен елемент? Схемата се основава на неговото електролит. Устройството включва малък контейнер, който е електролит сепаратор материал адсорбиран на. Освен това веригата на двете галванични елементи предполага катод и анод. Какво е името на такъв галваничен елемент? Веригата свързване на две метални предполага присъствие на окислително-редукционна реакция.
Елементарният електрохимичната клетка
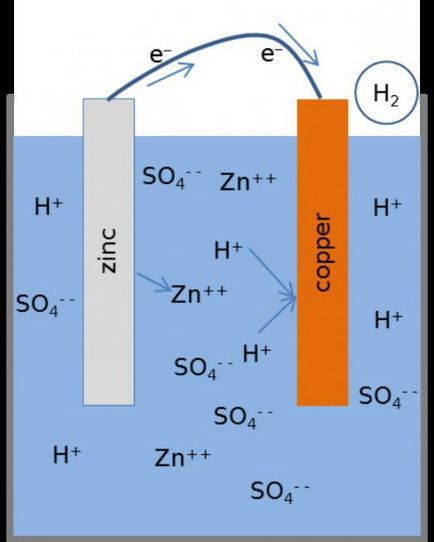
Това предполага съществуването на две плочи или пръти, изработени от различни метали, които се потапят в силна електролитен разтвор. При работа на електрохимичната клетка, процесът на окисляване анод се извършва свързан с електронен удар.
На катода - възстановяване, придружено с приемането на негативните частици. Има прехвърляне на електрони през външна верига за окислителя на редуктор.
Пример електрохимична клетка
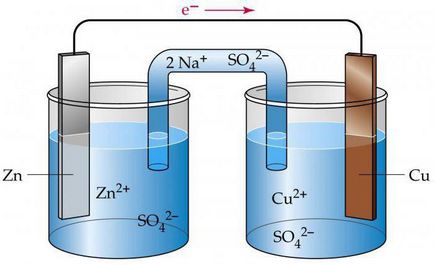
За да се направи на електронните схеми на електрохимични клетки, е необходимо да се знае стойността на стандартната потенциал електрод. Анализ изпълнение мед-цинков галванична клетка работи на базата на енергия освобождава по време на реакцията на мед с цинков сулфат.
Това електрохимична клетка, веригата, които ще бъдат дадени по-долу, по-нататък елемент-Jacobi Daniel. Той включва медна плоча, която се потапя в разтвор на меден сулфат (мед електрод) и се състои от цинков плоча, разположена в сулфатен разтвор (цинков електрод). Разтворите се свържат помежду си, но за да се избегне тяхното смесване елемент, използван в дял направена от порест материал.
принцип на работа
Как електрохимичната клетка, веригата има форма Zn Уг ZnSO4 ½½ CuSO4 Уг Cu? По време на работа, когато електрическата верига се затваря, има процес на окисление метален цинк.
На контактната повърхност със солев разтвор наблюдава атома преобразуване в катиони Zn2 + в. Процесът е съпроводен с освобождаването на "свободни" електрони, които се движат през външна верига.
Реакцията срещащи се в цинков електрод, може да бъде представена както следва:
Възстановяване на метални катиони се извършва при меден електрод. Отрицателните частици, които попадат тук с цинков електрод, се комбинират с катиони на мед, им се утаява под формата на метал. Процесът е както следва:
Ако се добавят две реакции, обсъдени по-горе, се получава общ уравнение описва действието на цинк-мед галваничен елемент.
цинкови действа като анод електрод, катодът е мед. Съвременните електрохимични клетки и батерии включват използването на един разтвор на електролит, който разширява обхвата на приложение, като тяхната работа по-комфортно и удобно.
Сортове електрохимични клетки
Най-често се счита въглерод-цинкови клетки. Те използват пасивна въглероден токоприемник свързване на анода, който действа като манганов оксид (4). Амониев хлорид електролит се използва във форма на паста.
Той не работи, така че той нарича галваничен елемент суха. черта му е способността да се "възстанови" по време на операцията, която влияе положително на продължителността на периода на поддържане. Такива електрохимични клетки са скъпи, но ниска мощност. При по-ниски температури намаляват нейната ефективност, и когато тя постепенно се увеличава електролит сушене.
Алкалните клетки включват използването на алкален разтвор, така че има много приложения.
В литиеви клетки действа като анод активен метал, който влияе положително на полезен живот. Литиево има отрицателен потенциал електрод, следователно с малки размери подобни елементи имат максимален номинално напрежение. Сред недостатъците на тези системи е възможно да се разпределят по-висока цена. Аутопсия източници литиев мощност е експлозивни.
заключение
Принципът на действие на всяка електрохимична клетка, се основава на редокс процеси, протичащи в катода и анода. В зависимост от метал избран електролитен разтвор, промяна на живота на клетката, както и големината на номиналното напрежение. В момента търсенето на литий, кадмий клетка с достатъчно дълъг период на правоотношението.