Crystal структура - Ръководства, страница 1
Видове кристални решетки. Твърдите вещества се разделят на кристални и аморфни. -Crystal тяло чрез нагряване остане твърдо вещество до определена температура (температура на топене), при което те преминават в течно състояние. Аморфен тяло по време на нагряването време в голям температурата на омекване; Първо те сгъстят и едва след това се втечни.
Всички метали и техните сплави - кристални твърди вещества. Метали, наречени химични елементи, които са характерните черти на непрозрачността, гланц, добра електрическа и топлинна проводимост, еластичността и за много метали способността да се заварява. За метали, характеризиращ се с това, че влизат в химична реакция с елементите е Xia неметали, те дават на последните външните електрони валентност. Това се дължи на факта, че металните атоми хлабаво свързани външните електрони от ядрото. Метали са на външната обвивка само 1-2 електрон, докато много неметали такива електрони (5-8).
Pure Chemical метални елементи (например, желязо, мед, алуминий и т.н.) могат да образуват комплекс вещество, чийто състав може да включва няколко метални елементи, често с примеси елементи, значителни количества от неметали. Такива вещества се разтварят се нарича-метални сплави. Прости острови вещества, които са алуминиеви компоненти, наречени сплав.
За да се опише кристалната структура на талий-IU използва терминът кристалната D-решетка. Кристалната решетка - е voobra zhaemaya триизмерна мрежа, възлите, които са разположени атоми (йони), образувайки Me-талий. Вещество частици (йони, атоми) на кото ryh вграден кристал разположен в геометричния модел lennom определено, че се повтаря Perio-чески в пространството. За разлика от кристали в аморфни твърди вещества (стъкло образуване-маса) атоми са разположени в пространството-бяс доста хаотично.
Образуването на кристалната решетка в IU талий, както следва. Когато NE-Минавайки метал от течност към твърдо състояние разстоянието между атоми се намалява и силата на взаимодействие между тях се увеличава. Характеризира трет атомен взаимодействие дефинирани БИЛД Niemi техните външни електронни черупки. При приближаване атома електрони, разположени на външните мембрани, губят контакт с техните атоми Мами-разделяне се дължи на валентност електрон на атом положително заредена ядро на друга и така нататък. Е. Образуването на свободи-електрони, тъй като те не принадлежат към един атом. Така в състояние метал твърдо вещество е структура, състояща се от положително заредени йони, промиват свободни електрони.
Комуникация в метала се извършва от електростатични сили. Между йони и свободни електрони възникне електростатично привличане сили, които стягат йони. Такава връзка между металните частици, наречени метал.
Свързващите сили в метали се определят чрез сили на отблъскване и привличане сили между IO-САЩ и електрони. Йоните са разположени на разстояние един от друг, при което потенциали потенциалната енергия минимум взаимодействието. метални йони са разположени в определен ред, за да образуват решетка. Та някои местоположение йони, предвидени чрез взаимодействие с валентните електрони кото-ръж свързват йони в кристалната решетка.
Видове кристални решетки в различни метали. Най-често срещаната решетка:
тяло центрирана кубична (Ск) - α-Fe, Cr, W, лице центрирана кубична (FCC) - у-Fe, А1, Cu, и
шестоъгълна плътно опаковани (НСР) - Mg, Zn и др.
Най-малкият размер на кристала, дава представа за атомна структура на метала в някоя от обема си, наречен елементарен кристален клетка (фиг.).
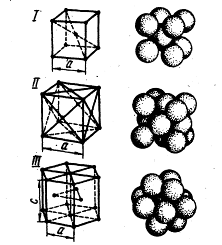
Фиг. I. В елементарна клетка на кристалните решетки:
I - тяло центрирана кубична (α желязо), II - лице центрирана кубична (мед), 111 - хепатит; А и В - решетъчни параметри
решетка Кристалната характеризира с параметри, например куб на дължина на страната за БКК и FCC, което е 2.8 за различни метали. 6 * 10 -8 cm.
Дефекти в кристали. В кристалите, винаги има дефекти (несъвършенства) структура, причинени от смущения на правилното позициониране на кристалната решетка на атома. DE-fects кристална структура, разделена на геометричните характеристики на точка, линия и повърхност.
Атомите осцилира до точките на решетка и температурата се увеличава амплитудата на тези вибрации се увеличава. По-голямата част от атомите на кристалната решетка има същото (средно) енергия диапазона и за дадена температура със същата амплитуда-вой. Въпреки това, отделните атоми нападения, дават енергия, значително по-висок среден Ener-ология, и да се премести от едно място на друго. Повечето атоми могат лесно да бъдат преместени върху nostnogo-слой, оставяйки повърхността. А мястото, където е налице такава атом се нарича свободно място (фиг. 2а).
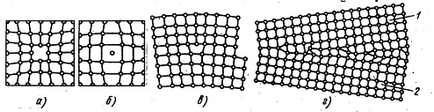
Фиг. 2. Дефекти в кристалите:
и - отворено положение, б - интерстициален атом, линеен ръб дислокация, г - неправилно разположение на атоми в границите на зърното 1 и 2
На това място след известно време се движат един от атомите на съседния слой и отворено положение така нататък. Е. така се движи във вътрешността на кристала. С повишаване на температурата се увеличава съвместно lichestvo места и те често NE-насилствено преместени от един възел към друг. В Дифи - прецизни процеси в металите, всичко в едно свободно място играят решаваща роля. За единична AF NYM дефекти са също атом изпъл-Рени в интерстициален решетка (фиг. 2Ь), и заместен атом когато пространството-MA атома на един метал в металната решетка се заменя от друг, чужд атом. Единична-AF целия дефекти предизвика локално нарушаване на кри-кристална решетка.
Линейни дефекти са изгледи на други съществени недостатъци XYZ кристална решетка в резултат на срязване на една interatomic разстояние на една част от решетка спрямо друго по продължение на равнината брой редове атоми в решетката на горната част на един по-голям, отколкото на дъното. В този случай, в горната част на решетката, както се оказа, каишка NJ атомно-равнина (допълнителните). Краят на допълнително перпендикулярна посока-niju изместване се нарича ръб или линеен дислокация (фиг. 2с), при което дължината на п-Jette достигне хиляди Ras interatomic разстояния. Намери широки дислокация-комплект разстояния от центъра до изкривявания пространство решетъчни дефекта без IC. ширина дислокация е малък и е в размер на няколко атомни разстояния.
Кристалната решетка размествания в зоната еластично деформирани, от атомите в тази зона се изместват по отношение на тяхната равновесно състояние-ТА. За дислокация характеризират с лесно в мобилността на. Това се дължи на факта, че атомите на генераторите на разполагане, има тенденция да се движат в състояние на равновесие. Размествания образуват Xia по време на кристализацията на метали (вж. Ch.1, § 2), както и пластична деформация-TION, топлинна обработка и други процеси.
Повърхностни дефекти са интерфейси между отделните кристали на кри, (фиг. 2d). В интерфейса между атомите на кристала са по-добре, отколкото в по-голямата част. Освен това, връзките се натрупват изкълчвания и места, и примеси се концентрират, което допълнително napyshaet реда на подреждане на атомите. Освен това, тези кристали се misoriented, т. Е. Може да се завърта спрямо друга от де syatki градуса. съдържание на метал може да се увеличи поради нарушаване на кристална решетка близо до границите или намаляване Xia поради наличието на примеси и концентрация де дефекти. Дефектите в кристалите значително да повлияят yayut свойства на метал.
Анизотропия кристали. Разлики Фи на физичните свойства на средата, в различни посоки се нарича анизотропия. Анизотропия поради кри-Stull разграничи плътност иРА-пресовото атома в решетката в различни посоки-niyah. Всички кристали са анизотропни и аморфни вещества (стъкло, смола) са изотропни, т.е.. Е. Има ODI-Накова плътност на атомите в различни посоки-leniyah.
На анизотропия на свойства е важно при използване на единични кристали - единични кристални частици, които са разположени равномерно в обема им. Единични кристали имат редовен кристал аспект (под формата на ЕС-естествено да polyhedra) от анизотропна Me-механично, електрически и други физични свойства.
Метали и сплави, използвани в областта, обикновено имат структура поликристалния, т.е.. Е. Състои се от множество Mel-FIR и различно ориентирани кристали не с нормална кристал нарязани и наречени кристалити (или зърна). Всеки зърно Поликристалната наблюдава анизотропия. Въпреки това, поради различни, произволно кристалографски ориентация-ING в различни равнини Поликристалната зърна могат да имат същите свойства на времето посока и не открие анизотропна-APY (когато размерът на зърното е значително по-малък от пода и кристала и броят им е много голям). Това обстоятелство в много случаи може да се разглежда като изотропно поликристален тяло, въпреки че Ани, анизотропията на свойствата на отделните съставни храни.
Преходът от течност към твърдо вещество (KRI-кристална), наречена кристализация. Процесите на кристализация зависят от изпарят температура и дебит във времето, така че кривите о охладят вградения-изпарят координати RA - време (Фигура 3.). Теоретично, т. Идеален процес метал ЛИЗАЦИЯ Е. Една без повторна кристализация охлаждане протича при температура Т 5 (Фиг. 3). При достигане идеално температура на втвърдяване Т 5 температура капка предварително ясно намалена. Това е така, защото peregrup-pirovka атоми по време на образуването на кристалната решетка е екзотермично (vyde-желаят да създаде латентна топлина на кристализация). Всяка чист метал (нелегирана) кристализира при строго постоянен темпера индивидуално обиколка. До края на втвърдяване на метал-perature тя падне отново.
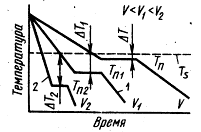
Фиг. 3. криви метал кристализация при охлаждане с различни скорости
На практика, кристализация протича при по-ниски температури, т.е.. Е. метал SRI subcooled до температура Тп, Tn Tn 1. 2 (например, измерва кривите 1, 2). Степен на преохлажда (АТ = T S -Tn) зависи от естеството и чистота IU талият на скоростта на охлаждане. В чист течния метал, по-податливи на преохлаждане. Чрез увеличаване на скоростта на охлаждане на степен увеличава преохлаждане и метал-novyatsya сто зърна фини, като по този начин подобряване на качеството. За повечето метали, степента на преохлаждане време на кристализацията в производствените състояние-вия от 10 до 30 ° С При високи скорости на охлаждане тя може да достигне до десет градуса.
Процесът на кристализация се състои от двеста-бои: ядрено - кристали (ядра или центрове) и кристален растеж от тези центрове. Когато преохлаждане на сплавта под Tn в много области на течния метал (фиг. 4а, б) са оформени в състояние на растеж-кри-кристални зародиши.
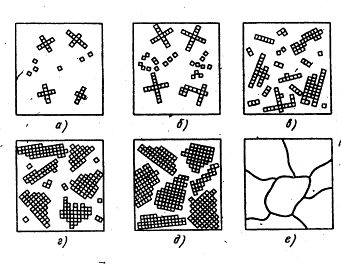
Фиг. 4. последователни етапи на процеса метал кристализация
Първо образува кристали Xia растат свободно и имат повече или по-малко правилна геометрична форма (фиг. 4, г, д). След това, при контакт Рас tuschih кристали с правилна форма Нара-гънки, тъй като в тези региони аспекти на предприсъединителните растеж ясно намалени. растеж на кристал продължава само в тези области, където има свободен достъп на стопения метал. Получените кристали, които са имали Chiyah първия геометрично-правилна форма, получена след втвърдяване неправилна форма, те се наричат кристалити или зърна (фиг. 4 д).